

肝胆膵外科
肝胆膵外科 患者の皆さまへ
肝胆膵外科のご紹介

肝胆膵外科では、肝胆膵領域の悪性疾患を中心に、胆石症などの胆道良性疾患、脾疾患ならびに食道胃静脈瘤などの診療を行っています。
悪性疾患では、肝癌、胆道癌、膵癌を主な対象疾患としています。悪性度の高い肝胆膵悪性疾患に対して、外科切除を中心に病態に応じた治療法を選択し、成績向上を目指しています。
肝癌や膵管内乳頭粘液性腫瘍(IPMN)や膵神経内分泌腫瘍(NET)などに対しては、根治性と切除の安全性に配慮した術式の選択を行っており、腹腔鏡下手術も積極的に行っています。
脾・門脈圧亢進症では、特発性血小板減少性紫斑病だけでなく、脾機能亢進症など脾腫症例に対しても腹腔鏡下脾臓摘出術を行っています。食道胃静脈瘤に対しては、内視鏡的硬化療法や静脈瘤結紮術を主体とした内視鏡的治療を行い、必要に応じてB-RTOや手術も選択しています。
肝胆膵外科への質問
- 肝胆膵の手術は難しいですか?
-
はい。難しいです。一般的に肝胆膵領域の手術、特に癌の手術は難しいと言われています。
安全かつ適切な治療を受けるためには、きちんとした施設で治療を受けることがとても重要です。そのため、一般社団法人日本肝胆膵外科学会(http://www.jshbps.jp)では、高度技能専門医制度を開始しました。
当院は、年間手術数の多い修練施設A(高難度肝胆膵外科手術を年間50例以上行っている施設)に認定されています。当科における高難度肝胆膵外科手術はすべて、高度技能専門医・高度技能指導医の立ち会いのもので行われています。 - 肝臓癌と診断されました。いくつかの治療法があると聞きましたが、
どの治療を受けたら良いのでしょうか? -
肝臓癌の治療には大きく分けて3つの方法があります。外科手術(肝移植を含む)、局所焼灼療法、化学療法(経動脈的塞栓術を含む)です。治療法の使い分けは、癌の大きさや存在部位によって異なります。実際に医師の間でも、どの治療法を選ぶべきか判断に迷うことがあります。
当院では、これらの治療法のスペシャリストが揃っており、どの治療法が最も適切かをカンファレンスで相談しながら決めています。医師の説明を通じて、それぞれの治療法を正しく理解された上で、適切な治療を受けていただきたいと願っています。是非われわれにご相談ください。 - 腹腔鏡下胆嚢摘出術で胆嚢をとってしまうと、手術後に何か支障はありますか?
- 一般患者さんの多くの方は、胆嚢で胆汁を作ると思われているようですが、それは間違いです。食べ物の消化を助ける胆汁は、胆嚢ではなく肝臓が作ります。胆嚢の働きは、胆汁を貯めて効率よく食べ物と混ぜること、また胆汁を凝縮することにとどまります。したがって、胆石のために炎症があるような胆嚢を摘出しても、ほとんどの患者さんに手術後影響が残ることはありません。ただし、中には数ヶ月の間、下痢が続く患者さんもおられます。
肝胆膵外科 臨床診療
肝胆膵外科では、肝胆膵領域の悪性疾患を中心に、胆石症などの胆道良性疾患、脾疾患ならびに食道胃静脈瘤などの診療を行っています。
悪性疾患では、肝癌、胆道癌、膵癌を主な対象疾患としています。悪性度の高い肝胆膵悪性疾患に対して、外科切除を中心とした治療法を選択し、抗癌剤治療を含めた集学的治療を導入することで、治療成績向上を目指しています。近年は、肝胆膵高難度症例に対する腹腔鏡下手術を積極的に導入し、良好な成績を収めています。
良性疾患で最も多いのは胆石症です。胆石症治療に関して当院は、全国でもいち早く腹腔鏡下胆嚢摘出術を導入しました。最近では、腹腔鏡下胆嚢摘出術を安全に施行するためのAIシステム開発にも取り組んでおり、胆嚢治療のメッカとして、常に最先端医療に取り組んでいます(図1)。
図1:AIによる腹腔鏡下胆嚢摘出術支援システム開発
膵・門脈圧亢進症では、特発性血小板減少性紫斑病だけでなく、
脾機能亢進症など脾腫症例に対しても腹腔鏡下脾臓摘出術を行っています。
最後に、肝胆膵外科疾患は難易度の高い術式を行うことが多くあります。わたしたちは、術前の診断から手術・術後管理まで、高いチームワークで取り組み、患者さんに最高の医療を提供するべく、one teamの精神で診療しています。

図2:肝胆膵グループメンバー
肝胆膵外科 基礎研究
1)肝胆膵悪性腫瘍の分子生物学的解析と新しい治療法の開発
Protease-activated receptor-2(PAR-2)
これまで蛋白を分解する効果しか持たないと考えられてきた蛋白分解酵素が、このProtease-activated receptor(PAR)というレセプターを介することで、細胞内のシグナリングにも関与することが明らかになり注目されています。このうちPAR-2は膵液中に存在するトリプシンにより活性化され、膵胆道領域疾患への関与が考えらえれています。これまでに胆嚢癌、膵腫瘍、膵癌でPAR-2が高率に発現していることを明らかにしました。(図1)
1. Shibata K, et al. Oncol Rep. 2004;12:1013-1016.
2. Yada K, et al. J Surg Oncol. 2005;89:79-85.
3. Iwaki K, et al. Int J Cancer. 2008;122:658-663.
4. Eguchi H, et al. J Hepatobilary Pncreat Sci 2011;18:147-153.
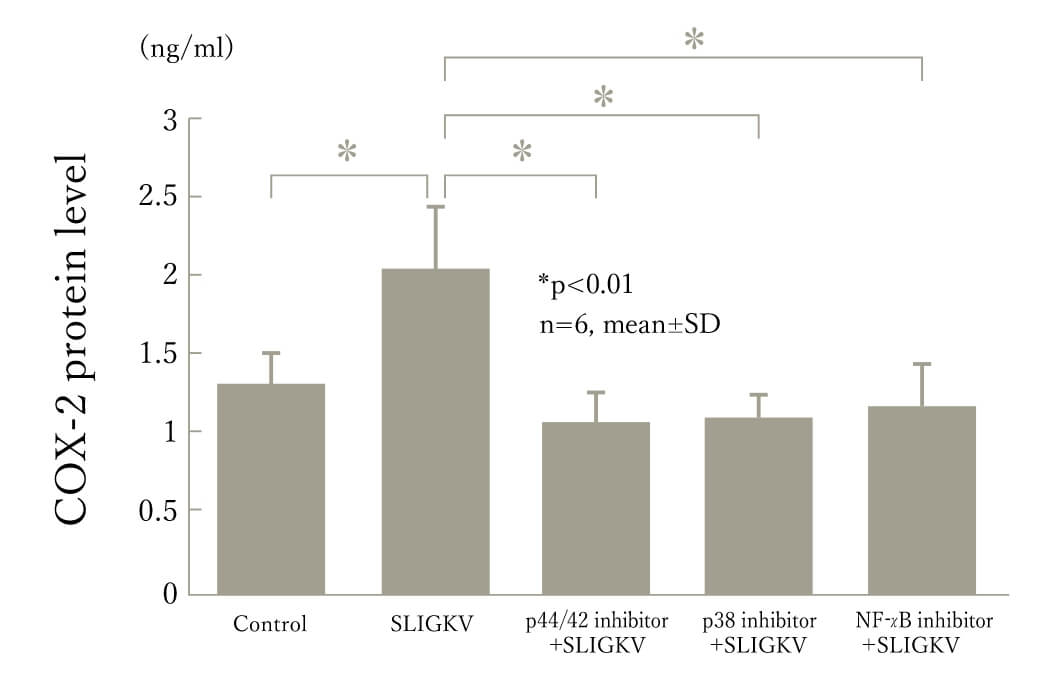 図1:PAR−2活性化シグナル経路阻害によるCOX-2蛋白発現の変化
図1:PAR−2活性化シグナル経路阻害によるCOX-2蛋白発現の変化
レクチンマイクロアレイ
糖鎖は細胞膜上の蛋白や脂質などの表面に発現し、生命活動に重要な役割を果たしており、癌化によりその糖鎖構造が変化することが知られております。レクチンは特定の糖鎖構造に結合する蛋白であり、当教室では各種消化器癌について、レクチンマイクロアレイ法を用いて糖鎖プロファイリングを行ってきました(図2)。 特に膵管内乳頭粘液性腫瘍(IPMN)において、悪性化に伴いレクチンAAL、AOLのシグナル強度の漸増を認めました。それに関連するフコース転移酵素であるFut8も同様に組織中の発現が増加しており、フコシル化がIPMNの悪性化に関与している可能性について報告しました。
5. Watanabe K, et al. Surg Today 2016 in press.
 図2:レクチンマイクロアレイ法に用いる
図2:レクチンマイクロアレイ法に用いるLecChip™とGlycoStation™(グライコテクニカ社)
2)門脈圧亢進症における胃粘膜障害のメカニズムの解明
門脈圧亢進症の胃粘膜においては易障害性があり、そのメカニズムの酸化ストレスが関与していると言われています。当教室では門脈圧亢進症胃粘膜において10%エタノールを投与後の酸化ストレスを測定し適応性保護作用の障害に酸化ストレスが関与し(図3)、内因性抗酸化物質グルタチオンが関連していることを明らかにしました(6)
6. Kawano Y, et al. J Gastroenterol Hepatol. 2013;28:639-644
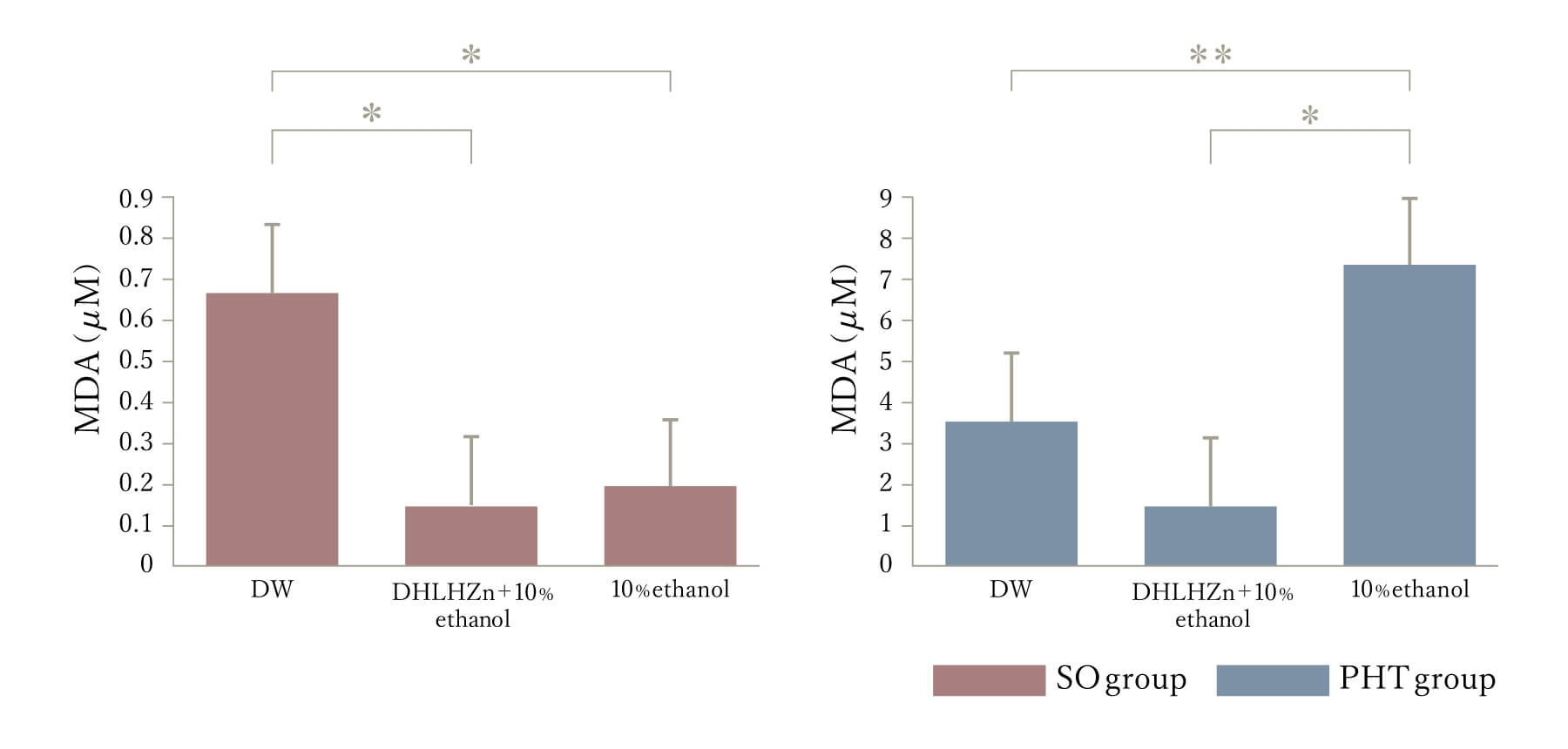 図3:10%エタノール投中のMDA与後の胃粘膜の変化
図3:10%エタノール投中のMDA与後の胃粘膜の変化
3)肝胆膵領域におけるαリポ酸誘導体の効果に関する基礎研究
近年、注目されている抗酸化物質の一つにαリポ酸があります。炎症性疾患、腫瘍性病変に対してその効果が期待されています。αリポ酸の欠点は、水に溶けにくく注射剤として使用することが困難な点です。そこでαリポ酸に改良を加え、dihydrolipoyl histidinate zinc complex(DHLHZn) が開発されました。αリポ酸の欠点を補い、静脈内投与が可能となり、多彩な効果が期待されています。
当教室ではラット肝虚血再灌流障害モデルにおいてDHLHZn投与が酸化ストレスを抑制し肝虚血再灌流障害を抑制することを明らかにしました(7)。
さらにCCI4を用いたラット肝線維化モデルにおいてDHLHZnが肝の線維化を抑制することを明らかにしました(8)。
7.Masuda T, et al. J Gastroenterol & Hepatol. 2011;26:1652-1658.
8. Kawano Y, et al. Surg Today 2014;44:1744-1750.